FDA zatwierdza lebrikizumab w AZS
| Tagi: | atopowe zapalenie skóry, AZS, lebrikizumab, FDA, lek, leczenie |
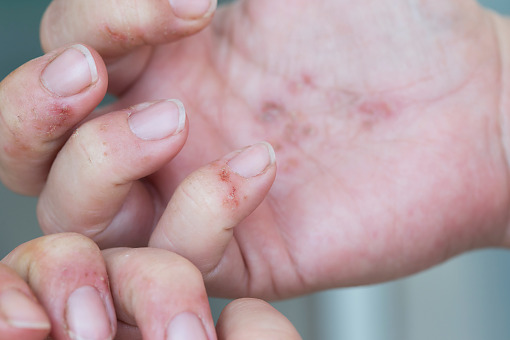
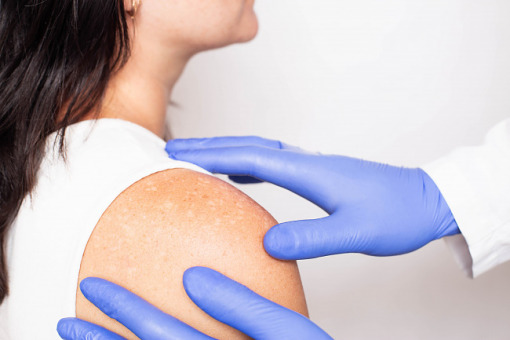
Amerykańska Agencja ds. Żywności i Leków (FDA) zatwierdziła celowany inhibitor interleukiny IL-13 lebrikizumab (Ebglyss) do leczenia dorosłych i dzieci w wieku 12 lat i starszych, którzy cierpią na umiarkowane lub ciężkie atopowe zapalenie skóry.
Zalecana początkowa dawka lebrikizumabu składa się z 500 mg (dwa wstrzyknięcia po 250 mg) na początku badania i w 2. tygodniu, a następnie 250 mg co 2 tygodnie do 16. tygodnia lub później, gdy zostanie osiągnięta odpowiednia odpowiedź kliniczna. Następnie zaleca się dawkowanie podtrzymujące z jednym miesięcznym wstrzyknięciem (250 mg co 4 tygodnie).
Dzieci w wieku od 12 do 17 lat muszą ważyć co najmniej 88 funtów (40 kg), aby kwalifikować się do leczenia lebrikizumabem.
Zgodnie z komunikatem prasowym firmy Lilly, która opracowuje lebrikizumab, zatwierdzenie zostało oparte na wynikach badań ADvocate 1, ADvocate 2 i ADhere, które objęły ponad 1000 dorosłych i dzieci w wieku 12 lat i starszych z umiarkowaną lub ciężką chorobą Alzheimera.
Pierwszorzędowy punkt końcowy w tych badaniach oceniano po 16 tygodniach i mierzono czystą lub prawie czystą skórę (wynik IGA 0 lub 1).
Według koncernu 38 proc. osób przyjmujących lebrikizumab w grupie ADvocate 1 i 2 uzyskało czystą lub prawie czystą skórę po 16 tygodniach, w porównaniu z 12 proc. osób w grupie placebo, a 10 proc. doświadczyło tych wyników już po 4 tygodniach. Spośród pacjentów leczonych lebrikizumabem, u których skóra była czysta lub prawie czysta w 16. tygodniu, 77 proc. utrzymywało te wyniki przez rok po podaniu raz w miesiącu.
Ponadto, zgodnie z komunikatem, średnio 43 proc. osób przyjmujących lebrikizumab doświadczyło złagodzenia swędzenia po 16 tygodniach, w porównaniu z 12 proc. osób przyjmujących placebo.
Najczęstsze działania niepożądane lebrikizumabu obserwowane w badaniach klinicznych obejmują zapalenie oczu i powiek, takie jak zaczerwienienie, obrzęk i swędzenie, jak też reakcje w miejscu wstrzyknięcia oraz półpasiec.
Lebrikizumab został zatwierdzony w Japonii w styczniu 2024 r., a przez Komisję Europejską w 2023 r.